Las bases o hidróxidos se caracterizan por tener el ion hidroxilo (OH)- en su composición. Se forman de la combinación entre un oxido básico mas agua.
Ejemplo:
igual es:
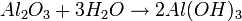
- NOMENCLATURA:
Para crear una base usando diversas nomenclaturas para ellas tomadas a partir de los nombres de los elementos y juntándolos con un ion hidroxilo (OH), tomando el número de valencia del elemento y combinarlos (cambiándolos de posición) como se muestra en la tabla:
| Fórmula | Tradicional | Stock | sistematica |
|---|---|---|---|
| Cu(OH) | Hidróxido cuproso | Hidróxido de cobre (I) | Monohidróxido de cobre |
| Cu(OH)2 | Hidróxido cúprico | Hidróxido de cobre (II) | Dihidróxido de cobre |
Cuando un elemento tiene más de dos valencias no se le pone nomenclatura tradicional. Al usar la menor valencia, el elemento termina en oso y cuando se usa la mayor termina en ico. En la nomenclatura Sistematica se le va a dar una conformación de prefijos al elemento según el numero de atomos que conforman la molecula (Mono, Di, Tri, Tetra, Penta, Hexa, etc) junto con la terminación-hidroxi u -oxidrilo que es el ion OH con carga −1.
NOTA:
Por esta razón es importante tener en cuenta la diferencia clara entre óxidos básicos y ácidos, pues la combinación de un oxido ácido con agua nos origina un hidracido (Compuesto derivado de los ácidos), el cual se estudiara mas adelante.
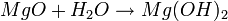
No hay comentarios:
Publicar un comentario