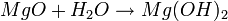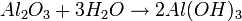PESO ATOMICO – PESO MOLECULAR
El peso atómico se define como la masa
de una mol de átomos del mismo elemento. Una mol equivale a 6.023 * 1023
átomos del mismo elemento. Si analizamos matemáticamente este número, nos damos
cuenta que se encuentra en notación científica y que es un número muy, pero muy
grande. Observémoslo en su expresión normal 602300000000000000000000, como
vemos esta alrededor delo cuatrillones. Esto pasa por que los átomos son
sustancias químicas muy, pero muy, pero muy pequeñas y, es muy difícil medir el
peso de un solo átomo, debemos medir el peso de esta cantidad de átomos para
que sea significativo. El peso atómico de cualquier elemento lo encuentran en
la tabla periódica, la cual va a ser importante que tengan para el desarrollo
de esta temática.
El peso molecular se define como la
sumatoria de los pesos atómicos de los elementos que conforman la molécula y también
equivaldría a hablar de una mol de moléculas de dicho compuesto.
Veamos algunos ejemplos:
Ejemplo
1: Peso molecular del
agua (H2O)
H = 2 * 1g = 2g
O =
1 * 16g = 16g
TOTAL = 18g
El primer dato, después del igual corresponde a el
número de átomos del elemento en la molécula y, el segundo valor corresponde a
el peso
atómico del elemento indicado en la tabla periódica. Se multiplican
estos valores y por último se suman los resultados obtenidos y, así se obtiene
el peso
molecular.
Ejemplo
2: Peso molecular del
ácido acetilsalicilico ( C9H8O4)
C = 9 * 12g = 108g
H = 8 * 1g = 8g
O =
4 * 16g = 64g
TOTAL = 180g
EJERCICIOS
Hallar
los pesos moleculares de los siguientes compuestos:
a) Ácido
sulfúrico H2SO4
b) Hidróxido
de aluminio Al(OH)3
c) Bicarbonato
de sodio NaHCO3
d) Oxido
férrico Fe2O3
e) Amoniaco
NH3
f) Sulfato
cúprico CuSO4