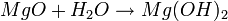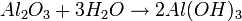Existen dos clases de ácidos: los hidracidos y los oxacidos.
OXACIDOS: Surgen de la combinación entre un oxido ácido (no metal + Oxigeno) y agua (Ver nota Cap. Bases). Son compuestos ternarios que tienen la siguiente fórmula general:
HxNOy siendo N un no metal. La cantidad de hidrógeno y oxígeno depende del número de oxidación del no metal por cuanto la suma total debe ser 0.
En el caso del ácido sulfúrico se tiene: 2 (+1) + 6 + 4. (-2) = 0
Es decir que el azufre actúa con el mayor número de oxidación (6). El hidrógeno acá tiene +1 y el oxígeno -2.
Reacción de formación:
SO3 + H2O --------------- H2SO4
Nomenclatura:
Tradicional:
Asigna la terminación oso al menor número de oxidación e ico al mayor. Si es necesario se utilizan los prefijos hipo y per. Esta nomenclatura sigue estando ampliamente difundida.
Ejemplos
HClO ácido hipocloroso
HClO2 ácido cloroso
HClO3 ácido clórico
HClO4 ácido perclórico
Numerales de Stock
Se nombran ácido --- prefijo que indica cantidad de oxígeno y el no metal con la terminación ---- ico ( ). Colocando entre paréntesis el número de oxidación del no metal.
HClO2 ácido dioxoclórico (III)
HClO3 ácido trioxoclórico (V)
Sistemática
Se indica la cantidad de oxígenos con el prefijo correspondiente --- oxo seguido del no metal con la terminación --- ato de hidrógeno.
Ejemplos
H2SO4 tetraoxosulfato de dihidrógeno o tetraoxosulfato (VI) de hidrógeno
HNO3 trioxonitrato de hidrógeno
HIDRACIDOS: Son combinaciones de átomos H con átomos de Halógenos (F, Cl, Br, I) o Calcógenos (S, Se, Te), los que actúan con valencia 1 y 2 respectivamente. Son compuestos moleculares gaseosos y su carácter ácido lo manifiestan cuando se disuelven en agua, dando soluciones ácidas.
NOMENCLATURA TRADICIONAL
Nombre genérico: Acido
Nombre específico: sufijo -hídrico a la raíz del nombre del elemento no metálico.
HF ácido fluorhídrico
HCl ácido clorhídrico
HBr ácido bromhídrico
HI ácido yodhídrico
H2S ácido sulfhídrico
H2Se ácido selenhídrico
H2Te ácido telurhídrico
NOMENCLATURA SISTEMÁTICA O STOCK
Se nombran, agregando el sufijo -uro a la raíz del nombre del elemento no metálico, seguido de la preposición de y de la palabra hidrógeno.
HF fluoruro de hidrógeno
HCl cloruro de hidrógeno
HBr bromuro de hidrógeno
HI yoduro de hidrógeno
H2S sulfuro de hidrógeno
H2Se seleniuro de hidrógeno